Teori Orbital Molekul
Bagaimana atom-atom membentuk ikatan kovalen untuk menghasilkan suatu molekul? Model molekul Lewis, yang menjelaskan bagaimana atom-atom berusaha melengkapi keadaan oktet melalui pemakaian bersama elektron hanya menceritakan sebagian dari sejarah.
Teori orbital molekul mengkombinasikan kecenderungan atom untuk mencapai keadaan oktet dengan sifat-sifat geombangnya, menempatkan elektron-elektron pada suatu tempat yang disebut orbital. Menurut teori orbital molekul, ikatan kovalen dibentuk dari kombinasi orbital-orbital atom membentuk orbital molekuler; yaitu orbital yang dimiliki oleh molekul secara keseluruhan. Seperti orbital atom, yang menjelaskan volume ruang di sekeliling inti atom di mana elektron mungkin ditemukan, orbital molekuler menjelaskan volume ruang di sekeliling molekul di mana elektron mungkin ditemukan.
Orbital molekuler juga memiliki bentuk ukuran dan energi yang spesifik. Mari kita lihat pada contoh pertama kita dalam molekul hidrogen (H2). Orbital 1s dari satu atom hidrogen mendekati orbital 1s dari atom hidrogen kedua, kemudian keduanya melakukan overlap orbital. Ikatan kovalen terbentuk ketika dua orbital s mengalami overlap, disebut dengan ikatan sigma (σ). Ikatan sigma berbentuk silindris simetris , elektron dalam ikatan ini terdistribusi secara simetris/ berada di tengah antara dua atom yang berikatan.
 |
| orbital molekul |
1. Atom Karbon
a. Hibridisasi sp3
Atom karbon memiliki dua orbital (2s dan 2p) untuk membentuk ikatan, artinya jika bereaksi dengan hidrogen maka akan terbentuk dua ikatan C-H. Faktanya, atom karbon membentuk empat ikatan C-H dan menghasilkan molekul metana dengan bentuk bangun ruang tetrahedron. Linus Pauling (1931) menjelaskan secara matematis bagaimana orbital s dan tiga orbital p berkombinasi atau terhibridisasi membentuk empat orbital atom yang ekuivalen dengan bentuk tetrahedral. Orbital yang berbentuk tetrahedral disebut dengan hibridisasi sp3. Angka tiga menyatakan berapa banyak tipe orbital atom yang berkombinasi, bukan menyatakan jumlah elektron yang mengisi orbital.
Atom karbon memiliki konfigurasi ground-state 1s2 2s2 2px1 2py1. pada kulit terluar terdapat dua elektron dalam orbital 2s, dan dua elektron tak perpasangan dalam orbital 2p:
 |
| Konfigurasi elektronik ground-state atom karbon |
Dari konfigurasi di atas, maka atom karbon hanya dapat membentuk dua ikatan, contohnya CH2. Pada kenyataannya, molekul CH2 sangat jarang ditemukan dan lebih banyak terbentuk molekul CH4. Dari hasil eksperimen, diperoleh data bahwa kekuatan ikatan CH sebesar 100 kkal/mol. Dengan demikian, energi untuk membentuk ikatan C-H dalam CH2 sebesar 200 kkal/mol.
Alternatifnya adalah, satu elektron pada orbital 2s dipromosikan ke orbital 2pz. Konfigurasi baru ini memiliki satu elektron yang berada pada tingkat energi yang lebih tinggi dari ground-state. Energi yang dibutuhkan untuk mempromosikan elektron tersebut sebesar 96 kkal/mol.
 |
| Konfigurasi elektron atom karbon yang mengalami eksitasi |
Pada posisi tereksitasi, karbon memiliki empat elektron tak berpasangan dan dapat membentuk empat ikatan dengan hidrogen. Meskipun membutuhkan energi sebesar 96 kkal/mol untuk mengeksitasi satu elektronnya terlebih dahulu, ikatan yang terbentuk dengan H (pada CH4) jauh lebih stabil dibandingkan ikatan C-H pada
molekul CH2. Ikatan C-H pada metana memiliki kekuatan ikatan 104 kkal/mol
dengan panjang ikatan 1.10 A. sudut ikatan H-C-H sebesar 109.50.
Struktur etana
Etana, C2H6, merupakan contoh paling sederhana dari molekul yang mengandung ikatan karbon-karbon.
 |
| Struktur Lewis dan Kekule dari etana |
Ikatan karbon-karbon dalam etana memiliki panjang ikatan 1.54 A dan kekuatan ikatn 88 kkal/mol. Untuk ikatan C-H memiliki karakteristik yang sama dengan metana.
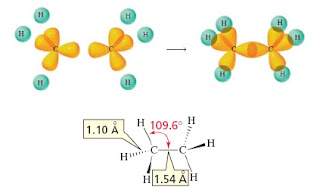 |
| Struktur Etana |
lanjut penjelasan : b. Hibridisasi sp2; Orbital dan Struktur Etilen pada post berikutnya
sumber : KIMIA ORGANIK 1 JILID 1 penulis: Stefanus Layli Prasojo, S.Farm., Apt.
Advertisement

{ 0 komentar... read them below or add one }
Posting Komentar